三阴性乳腺癌的免疫治疗一直面临巨大挑战。尽管免疫检查点阻断疗法为部分癌症患者带来希望,但对这一侵袭性强、治疗选择有限的乳腺癌亚型,响应率仍不尽如人意。许多患者的肿瘤微环境呈现一种「免疫排斥」状态 —— 免疫细胞被致密的基质物理性阻挡在外,难以识别并攻击肿瘤细胞。这种现象背后究竟隐藏着怎样的机制?近年来,复旦大学附属肿瘤医院邵志敏教授与江一舟教授团队围绕这一难题展开系统探索,逐渐揭开了肿瘤微环境中一场复杂的「三方对话」。
复旦大学附属肿瘤医院邵志敏教授与江一舟教授团队长期深耕 TNBC 研究,围绕分子分型、代谢重编程、微环境塑造及治疗抵抗开展了系统性探索。团队于 2023 年 8 月以及 2025 年 10 月在《Cell Metabolism》和 2023 年 10 月《Nature Communications》等期刊上揭示了 TNBC 脂质、丝氨酸等代谢通路的异常及其促癌机制,识别出多个潜在靶点,并构建了基于代谢特征的亚型体系。团队在 2024 年 8 月的《Advanced Science》和 2025 年 3 月《Med》上的研究,则分别揭示了代谢重编程对免疫细胞的调节作用以及 DNA 损伤修复介导的耐药机制。此外,团队利用单细胞与空间技术解析了乳腺癌微环境的细胞组成与空间互作,逐步完善了以「复旦分型」为核心的精准诊疗体系。
随后,团队在 2025 年 7 月发表于《Nature Medicine》上的研究进一步拓展认知,通过单细胞测序首次在 TNBC 中鉴定出一类具有抗原递呈功能的肥大细胞亚群(apMCs)。该群细胞富集与 PD-1 抑制剂疗效正相关,而抗过敏药可增强其功能。基于此开展的 II 期临床试验在耐药患者中取得了 50% 的客观缓解率,实现了从机制发现到「老药新用」的快速临床转化。值得一提的是,团队在微环境调控方面研究深入,例如于 2025 年 9 月在《Cancer Cell》上发表的研究揭示了化疗通过诱导中性粒细胞外陷阱唤醒休眠癌细胞并促进转移的机制,为联合治疗提供了新思路。小编统计了邵志敏教授与江一舟教授团队历年发表的研究论文放在文末参考文献列表里供大家查阅,可能还有一些未统计到的研究,欢迎在评论区补充。
在此基础上,2026 年 2 月 5 日,团队取得新的突破。复旦大学附属肿瘤医院乳腺外科江一舟/邵志敏/肖毅团队,联合复旦大学脑科学转化研究院倪金飞研究员团队在《Cell》上的研究首次揭示,肿瘤内感觉神经元通过释放 CGRP 神经肽「策反」 癌相关成纤维细胞,促其分泌胶原形成物理屏障,驱动免疫排斥 [1]。这为使用已获批上市的用于治疗偏头痛的 CGRP 拮抗剂瑞美吉泮(Rimegepant,已在偏头痛等疾病领域具有成熟的临床应用基础和安全性数据。)破除屏障、提升免疫疗效提供了直接路径。该系列研究从「代谢 — 微环境 — 神经 — 免疫」的多维交互视角,系统阐释了 TNBC 免疫排斥的成因,并将团队长期研究脉络延伸至神经免疫与髓系细胞调控前沿,体现了从基础机制到临床解决方案的连贯思路,为克服免疫治疗耐药提供了新策略。
图 1:文章来源(图源:[1])
为探究肿瘤微环境中神经与基质细胞的直接对话,研究团队综合利用临床队列的多组学数据、空间转录组学及小鼠模型展开研究。他们首先发现,在三阴性乳腺癌(TNBC)中,周围神经侵犯(PNI)与富含胶原的纤维化间质及贫乏的免疫细胞浸润显著相关。通过神经亚型鉴定,他们进一步锁定感觉神经元是肿瘤内最主要的神经类型(约占 70%)。关键的证据来自空间分析:在 PNI 区域周围,活化的癌症相关成纤维细胞(CAFs,特别是表达 α-SMA 的肌成纤维细胞样 CAFs)密度显著升高。体外共培养实验证实,感觉神经元释放的神经肽 CGRP 是其激活 CAF 的关键信使。有趣的是,单细胞测序数据显示,CGRP 的受体 RAMP1 在 CAF 上特异性高表达,尤其是在肌成纤维细胞样 CAF 亚群上,这为「神经元-CAF」 的特异性通讯提供了分子基础。
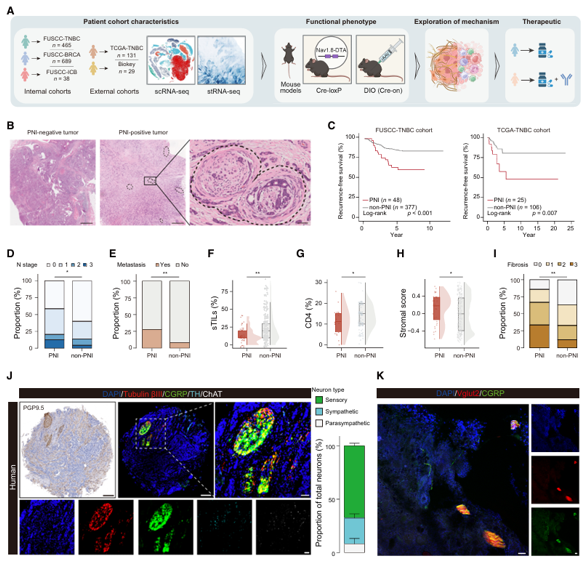
图 2 PNI 与肿瘤微环境的失调有关(图源:[1])
明确「信使」CGRP 与「接收器」RAMP1 后,研究团队深入解析了这条轴线下达的「施工指令」。他们发现,CGRP 与 CAF 上的 RAMP1 结合后,激活了经典的 cAMP/PKA/CREB1 信号通路。其中,转录因子 CREB1 被磷酸化激活后,直接结合到多个细胞外基质相关基因(如 Col1a1、Fn1)的启动子区,如同按下了「加速生产」的开关,强力驱动 I 型胶原等基质的转录与合成。在功能上,接受 CGRP 刺激的 CAF 收缩和迁移能力增强,在三维培养中形成了更致密的胶原网络。在动物模型中,特异性敲低 CAF 中的 Ramp1 或 Creb1 基因,能有效阻断感觉神经元激活所诱导的胶原过度沉积和肿瘤加速生长,并恢复 CD8+ T 细胞的浸润,从遗传学角度验证了该轴心的核心地位。
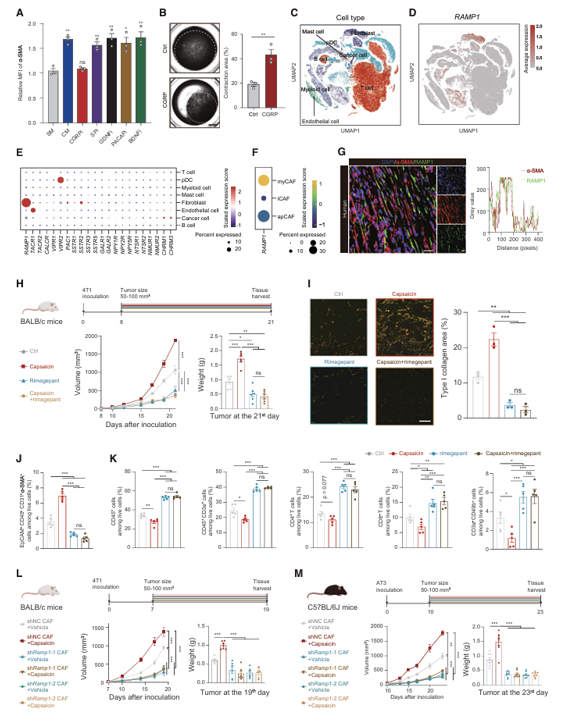
图 3 感觉神经元来源的 CGRP 与 CAFs 上的 RAMP1 结合,促进胶原分泌(图源:[1])
本研究突破了既往对肿瘤微环境的认知框架,首次系统阐明感觉神经元 — 癌症相关成纤维细胞轴是驱动三阴性乳腺癌免疫排斥的关键机制,神经疾病的治疗药物有望在抗肿瘤治疗领域实现「老药新用」,使患者获益。邵志敏教授与江一舟教授团队长期致力于三阴性乳腺癌的异质性解析与精准治疗策略探索,已形成一系列具有系统性与延续性的重要研究成果。
团队早期与 2019 年 3 月在《Cancer Cell》发表研究,通过对多组学数据的分析,首次建立了三阴性乳腺癌的「复旦分型」,包括腔面雄激素受体型、免疫调节型、基底样免疫抑制型及间质型,揭示了各亚型特征与靶点,为后续精准治疗奠定基础。随后,团队在 2021 年 6 月在《Cell Metabolism》发表的文章从代谢组学入手,构建代谢图谱,解析代谢异质性,识别出 S1P、NAAG 等关键代谢物,拓展了代谢干预的方向。进一步地,2023 年 10 月发表于《Science Advances》的文章通过多组学整合明确了代谢通路异质性,并依据代谢特征划分出脂质合成型、糖酵解型与混合型亚型,为靶向干预提供依据;同时创新结合放射基因组学,从影像层面刻画肿瘤异质表型,并发现其与铁死亡等代谢紊乱相关。
在蛋白质相互作用方面,早在 2021 年 6 月发表于《Nature Cancer》的研究发现 MTDH-SND1 复合物在乳腺癌进展中的关键作用,并筛选出小分子抑制剂 C26-A2 与 C26-A6,显著抑制肿瘤进展与转移。另一项 2025 年 11 月发表在《Cell Discovery》上的工作,通过多组学数据系统描绘乳腺癌基因融合全景,鉴定出 ADK 基因融合作为激素受体阳性乳腺癌的新驱动靶点。2025 年 6 月在《Cancer Cell》上发表的研究,则聚焦抗体偶联药物 SHR-A1811 的疗效空间决定因素,揭示微环境中细胞空间分布与治疗反应的关系,引入空间组学新视角。
这些从分子分型、代谢异质、影像表型、蛋白互作、基因融合到空间微环境的研究,逐步深化了对三阴性乳腺癌生物学复杂性的认识,也为从「神经元 — 基质 — 免疫」交互视角揭示免疫排斥机制奠定了理论与方法基础。
本研究的创新在于,将神经调控、基质重塑与免疫逃逸三大过程联系起来,并明确了 CGRP-RAMP1 信号通路可作为克服免疫治疗耐药的关键靶点。研究进一步提出,已临床用于偏头痛的 CGRP 受体拮抗剂有望作为「基质软化剂 」,与抗 PD-1 疗法联用,在临床前模型中显示出显著协同效果,具备快速转化潜力。然而,该策略迈向临床仍面临几方面挑战:需验证 CGRP 能否作为预测免疫疗效的生物标志物以实现患者分层;需明确干预该通路的最佳治疗时机与疗程;并需系统评估长期抑制 CGRP 信号对神经功能及免疫稳态的潜在影响,以确保治疗安全有效。
文献参考:
[1] Zhang, Si-Wei et al. 「Sensory neurons drive immune exclusion by stimulating a dense extracellular matrix in the breast cancer tumor microenvironment.」 Cell 189, 1–17. 19 Feb. 2026,
doi:10.1016/j.cell.2026.01.001.
[2] Xiao Y, Xu Y, Wang H, Yang F, Ding XH, Fu T, Chen L, Jin X, Zhao YX, Wang Y, Chen F, Shao ZM, Jiang YZ. HEBP2-governed glutamine competition between tumor and macrophages dictates immunotherapy efficacy in triple-negative breast cancer. Cell Metab. 2025 Oct 7;37(10):2030-2047.e7. doi: 10.1016/j.cmet.2025.08.009. Epub 2025 Sep 23. PMID: 40992373.
[3] Deng Q, Qiang J, Liu C, Ding J, Tu J, He X, Xia J, Peng X, Li S, Chen X, Ma W, Zhang L, Jiang YZ, Shao ZM, Chen C, Liu S, Xu J, Zhang L. SOSTDC1 Nuclear Translocation Facilitates BTIC Maintenance and CHD1-Mediated HR Repair to Promote Tumor Progression and Olaparib Resistance in TNBC. Adv Sci (Weinh). 2024 Aug;11(29):e2306860. doi: 10.1002/advs.202306860. Epub 2024 Jun 12. PMID: 38864559; PMCID: PMC11304230.
[4] Xiao Y, Yu TJ, Xu Y, Ding R, Wang YP, Jiang YZ, Shao ZM. Emerging therapies in cancer metabolism. Cell Metab. 2023 Aug 8;35(8):1283-1303. doi: 10.1016/j.cmet.2023.07.006. PMID: 37557070.
[5] Wu SY, Fu T, Jiang YZ, Shao ZM. Natural killer cells in cancer biology and therapy. Mol Cancer. 2020 Aug 6;19(1):120. doi: 10.1186/s12943-020-01238-x. PMID: 32762681; PMCID: PMC7409673.
[6] Zhao S, Chen DP, Fu T, Yang JC, Ma D, Zhu XZ, Wang XX, Jiao YP, Jin X, Xiao Y, Xiao WX, Zhang HY, Lv H, Madabhushi A, Yang WT, Jiang YZ, Xu J, Shao ZM. Single-cell morphological and topological atlas reveals the ecosystem diversity of human breast cancer. Nat Commun. 2023 Oct 25;14(1):6796. doi: 10.1038/s41467-023-42504-y. PMID: 37880211; PMCID: PMC10600153.
[7] Wu SY, Jin X, Liu Y, Wang ZY, Zuo WJ, Ma D, Xiao Y, Fu T, Xiao YL, Chen L, Liu XY, Fan L, Wang ZH, Shen M, Liu R, Chai WJ, Shao ZM, Jiang YZ. Mobilizing antigen-presenting mast cells in anti-PD-1-refractory triple-negative breast cancer: a phase 2 trial. Nat Med. 2025 Jul;31(7):2405-2415. doi: 10.1038/s41591-025-03776-7. Epub 2025 Jun 25. PMID: 40563015.
[8] Wu HL, Gong Y, Ling YX, Wu SY, Ji P, Zhao Q, He LH, Shao ZM, Jiang YZ, Liu GY. DHDH-mediated D-xylose metabolism induces immune evasion in triple-negative breast cancer. Med. 2025 Mar 14;6(3):100535. doi: 10.1016/j.medj.2024.10.012. Epub 2024 Nov 8. PMID: 39520982.
[9] Song XQ, Yu TJ, Ou-Yang Y, Ding JH, Jiang YZ, Shao ZM, Xiao Y. Copy number amplification of FLAD1 promotes the progression of triple-negative breast cancer through lipid metabolism. Nat Commun. 2025 Feb 1;16(1):1241. doi: 10.1038/s41467-025-56458-w. PMID: 39890808; PMCID: PMC11785949.
[10] He D, Wu Q, Tian P, Liu Y, Jia Z, Li Z, Wang Y, Jin Y, Luo W, Li L, Zhang P, Jin Q, Zhao W, Hu W, Liang Y, Zhou B, Yang Q, Jiang YZ, Shao ZM, Hu G. Chemotherapy awakens dormant cancer cells in lung by inducing neutrophil extracellular traps. Cancer Cell. 2025 Sep 8;43(9):1622-1636.e7. doi: 10.1016/j.ccell.2025.06.007. Epub 2025 Jul 3. PMID: 40614736.
[11] Gong Y, Ji P, Yang YS, Xie S, Yu TJ, Xiao Y, Jin ML, Ma D, Guo LW, Pei YC, Chai WJ, Li DQ, Bai F, Bertucci F, Hu X, Jiang YZ, Shao ZM. Metabolic-Pathway-Based Subtyping of Triple-Negative Breast Cancer Reveals Potential Therapeutic Targets. Cell Metab. 2021 Jan 5;33(1):51-64.e9. doi: 10.1016/j.cmet.2020.10.012. Epub 2020 Nov 11. PMID: 33181091.
[12] Su GH, Xiao Y, You C, Zheng RC, Zhao S, Sun SY, Zhou JY, Lin LY, Wang H, Shao ZM, Gu YJ, Jiang YZ. Radiogenomic-based multiomic analysis reveals imaging intratumor heterogeneity phenotypes and therapeutic targets. Sci Adv. 2023 Oct 6;9(40):eadf0837. doi: 10.1126/sciadv.adf0837. Epub 2023 Oct 6. PMID: 37801493; PMCID: PMC10558123.
[13] Ou-Yang Y, Ma D, Lin CJ, Yang YS, Liu CL, Hou J, Jin X, Shao ZM, Jiang YZ. Landscape of gene fusions in hormone receptor-positive breast cancer reveals ADK fusions as drivers of progression and potential therapeutic targets. Cell Discov. 2025 Nov 11;11(1):89. doi: 10.1038/s41421-025-00830-z. PMID: 41213951; PMCID: PMC12603066.
[14] Ma D, Dai LJ, Wu XR, Liu CL, Zhao S, Zhang H, Chen L, Xiao Y, Li M, Zhao YZ, Yang L, Zhou T, Li JJ, Yang WT, Jiang YZ, Shao ZM. Spatial determinants of antibody-drug conjugate SHR-A1811 efficacy in neoadjuvant treatment for HER2-positive breast cancer. Cancer Cell. 2025 Jun 9;43(6):1061-1075.e7. doi: 10.1016/j.ccell.2025.03.017. Epub 2025 Apr 10. PMID: 40215979.
[15] Fu T, Dai LJ, Wu SY, Xiao Y, Ma D, Jiang YZ, Shao ZM. Spatial architecture of the immune microenvironment orchestrates tumor immunity and therapeutic response. J Hematol Oncol. 2021 Jun 25;14(1):98. doi: 10.1186/s13045-021-01103-4. PMID: 34172088; PMCID: PMC8234625.
[16] Shen M, Wei Y, Kim H, Wan L, Jiang YZ, Hang X, Raba M, Remiszewski S, Rowicki M, Wu CG, Wu S, Zhang L, Lu X, Yuan M, Smith HA, Zheng A, Bertino J, Jin JF, Xing Y, Shao ZM, Kang Y. Small-molecule inhibitors that disrupt the MTDH-SND1 complex suppress breast cancer progression and metastasis. Nat Cancer. 2022 Jan;3(1):43-59. doi: 10.1038/s43018-021-00279-5. Epub 2021 Nov 29. PMID: 35121987; PMCID: PMC8818087.
[17] Jiang YZ, Ma D, Suo C, Shi J, Xue M, Hu X, Xiao Y, Yu KD, Liu YR, Yu Y, Zheng Y, Li X, Zhang C, Hu P, Zhang J, Hua Q, Zhang J, Hou W, Ren L, Bao D, Li B, Yang J, Yao L, Zuo WJ, Zhao S, Gong Y, Ren YX, Zhao YX, Yang YS, Niu Z, Cao ZG, Stover DG, Verschraegen C, Kaklamani V, Daemen A, Benson JR, Takabe K, Bai F, Li DQ, Wang P, Shi L, Huang W, Shao ZM. Genomic and Transcriptomic Landscape of Triple-Negative Breast Cancers: Subtypes and Treatment Strategies. Cancer Cell. 2019 Mar 18;35(3):428-440.e5. doi: 10.1016/j.ccell.2019.02.001. Epub 2019 Mar 7. PMID: 30853353.
[18] Xiao Y, Ma D, Yang YS, Yang F, Ding JH, Gong Y, Jiang L, Ge LP, Wu SY, Yu Q, Zhang Q, Bertucci F, Sun Q, Hu X, Li DQ, Shao ZM, Jiang YZ. Comprehensive metabolomics expands precision medicine for triple-negative breast cancer. Cell Res. 2022 May;32(5):477-490. doi: 10.1038/s41422-022-00614-0. Epub 2022 Feb 1. PMID: 35105939; PMCID: PMC9061756.
来源:丁香通





